الـواحــة الطلابيــة للجـامعــة الوطنيــة الخـاصــة
Student Oasis of Al-Wataniya Private University
عنوان الحلقة البحثية : الخلايا الجذعية وهم أم أمل متجدد
مسابقة أفضل حلقة بحثية طلابية - كلية الصيدلة -

الأستاذ المشرف
د.طلة المللي

اعداد الطالبة
قمر بسام مفتاح

اعداد الطالبة
مريم مرعي خلوف الصطيف

اعداد الطالبة
لما عبد الكريم السنكري
- مسابقة أفضل حلقة بحثية طلابية
- طب الأسنان
- الصيدلة
- الهندسة ( معلوماتية و اتصالات )
- الهندسة المدنية
- هندسة العمارة و التخطيط العمراني
- العلوم الإدارية و المالية
Stem Cells therapy… Illusion or renewed hope?
المخلص Abstract:
الخلايا الجذعية: هي خلايا غير متخصصة في جسم الإنسان قادرة على التمايز لأي خلية أو عضو في جسمنا و لها القدرة على التجدد الذاتي حيث تتواجد الخلايا الجذعية في كل من خلايا الأجنة و البالغين. هناك عدة أنواع من الخلايا الجذعية: كاملة القدرة TSC, وافرة القدرة PSC, متعددة القدرة MSC,محدودة القدرة OSC, وحيدة القدرة USC. و استطاعت بعض أنواع الخلايا الجذعية أن تكون نقطة تحول لعلاج بعض الأمراض مثل: زراعة الخلايا الجذعية المُكوّنة للدّم. كما لايزال هناك الكثير من الأبحاث لاستخدام الخلايا الجذعية لعلاج العديد من الأمراض مثل: الأمراض التنكسية كباركينسون عن طريق توليد خلايا عصبية دوبامينية .
في حلقة البحث هذه، حاولنا وبشكل مختصر تسليط الضوء على أهم النقاط التي يجب معرفتها حول أنواع الخلايا الجذعية من حيث قدرتها على التمايز، العلاج بالخلايا الجذعية، و أخيراً ماهي العقبات التي تعترض مستقبل هذا العلاج الذي حمل بين طياته أملاً متجدداً.
الخلايا الجذعية Stem cells:
هي خلايا غير متخصصة في جسم الإنسان قادرة على التمايز لأي خلية أو عضو في جسم الإنسان و لها القدرة على التجدد الذاتي حيث تتواجد الخلايا الجذعية في كل من خلايا الأجنة و البالغين.
وقبل أن نبدأ حديثنا عن الدور العلاجي المحتمل للخلايا الجذعية ، دعونا نصنف هذه الخلايا تبعاً لقدرتها على التمايز لنوع معين أو عدة أنواع، الشكل (1):
- الخلايا الجذعية كاملة القدرة Totipotent Stem cells:
هذه الخلايا قادرة على الانقسام والتمايز لجميع أنواع الأنسجة وهي تمتلك أعلى قدرة على التمايز و تسمح للخلايا بتشكيل بُنى جنينية و خارج جنينية مثل: البيضة الملقحة Zygote التي تتشكل بعد إخصاب النطفة لها و تبدأ بالانقسام إلى مجموعة من الخلايا التي لها أيضاً القدرة الكاملة على التخصص. أي يمكن لأي خلية من هذه الخلايا إذا زُرعت في رحم أنثى أن تكوِّن جنيناً كاملاً مع الأنسجة المدعمة له. فبعد أربعة أيام تقريباً من انقسام البيضة الملقحة، تتشكل الكيسة الأرومية blastocyst و بداخلها كتلة الخلايا الداخلية inner cell mass تُكوِّن خلايا هذه الكتلة، الجنين بجميع أنسجته وأعضائه لكنها و بخلاف الخلايا كاملة القدرة غير قادرة على تكوين كائن حي بمفردها بسبب كونها غير قادرة على تكوين الأنسجة المدعمة للجنين، هذه الخلايا ستكون مصدراً للخلايا الجذعية وافرة القدرة.
- الخلايا الجذعية وافرة القدرة Pluripotent Stem cells:
تشكل هذه الخلايا كل طبقات الجنين ) الوريقات الجنينية التي تتكون من أديم خارجي, متوسط و داخلي( و لكن لا تشكل البُنى خارج الجنينية كالمشيمة مثال عنها: الخلايا الجذعية الجنينية Embryonic stem cells و الخلايا المشتقة من الأديم الخارجي Epiblasts Layer من الجنين المنغرس.
- الخلايا الجذعية متعددة القدرة Multipotent Stem cells:
تمتلك طيفاً ضيقاً من التمايز مقارنة بالخلايا وافرة القدرة حيث يمكنها التمايز إلى جميع أنواع الخلايا لكن ضمن سلالة معينة, فهناك مزايا و استخدامات كثيرة للخلايا الجذعية متعددة القدرة. تعمل الخلايا الجذعية متعددة القدرة كمفتاح مهم في عملية التطوير و إصلاح الأنسجة و حمايتها مثال عنها: الخلايا الجذعية المكونة للدم Haematopoietic stem cells التي يمكنها التطور لأي نوع من خلايا الدم, فبعد تمايز الخلايا الجذعية المكونة للدم تصبح خلية جذعية محدودة القدرة oligopotent stem cells.
- الخلايا الجذعية محدودة القدرة Oligopotent Stem cells :
تمتلك هذه الخلايا قدرة التمايز لأنواع محدودة من خلايا الأنسجة مثال: الخلايا الجذعية النقوية myeloid stem cells التي تنقسم لخلايا بيضاء فقط (العدلات، الأسسات و الحمضات) و لا تعطي كريات حمراء, مثال آخر: الخلايا الجذعية القصبية السنخية (BASCs) في الرئتين قليلة القدرة و يمكن أن تتمايز إلى خلايا ظهارية قصبية أو خلايا ظهارية سنخية.
- الخلايا الجذعية وحيدة القدرة Unipotent Stem cells:
تمتلك أضيق طيف في التمايز مقارنة بباقي الأنواع و لكن من ميزاتها التي جعلتها محط اهتمام الطب التجديدي هي قدرتها على الانقسام بشكل متكرر و تخصصها بتشكيل نوع واحد من الخلايا
مثال: الخلايا الجلدية dermatocytes.
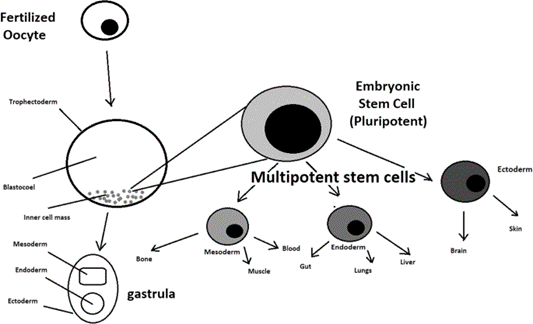
الشكل (1): تطور البويضات وتكوين الخلايا الجذعية. يتكون الكيس الأرومي، الذي يتشكل من البويضات، من خلايا جذعية جنينية تتمايز لاحقًا إلى خلايا الأديم المتوسط mesoderm، أو الأديم الخارجيectoderm، أو الأديم الداخليendoderm. يتطور يتكون الكيس الأرومي إلى المعيدة gastrula
الانقسام الوظيفي للخلايا الجذعية Stem cell functional division:
كما لاحظنا آنفاً فإنّ وجود الخلايا الجذعية المختلفة أثناء الانقسام يعتمد على مرحلة تطور الكائن الحي. و بشكل عام يمكننا تقسيم الخلايا الجذعية تبعا للانقسام الوظيفي إلى:
- الخلايا الجذعية الجنينية Embryonic stem cells:
تشتق الخلايا الجذعية الجنينية من كتلة الخلايا الداخلية للكيسة الأرومية، و هي مرحلة ما قبل تعشيش الجنين أي 4 أيام بعد الإخصاب. بعد ذلك، يتم وضع هذه الخلايا في طبق زرع مملوء بوسط مغذٍ. يمكن وصف هذه الخلايا بأنها متعددة القدرات لأنها قادرة مستقبلاً على التمايز إلى أي نوع من الخلايا في الكائن الحي. منذ بداية دراسة هذا النوع من الخلايا، كانت هناك قيود أخلاقية مرتبطة بالاستخدام الطِّبي للخلايا الجذعية الجنينية في العلاج. يتم تطوير معظم الخلايا الجذعية الجنينية من بويضات تم تخصيبها مخبرياًinvitro ، و ليس من بويضات مخصّبة في الجسم الحي invivo.
- الخلايا الجذعية الجسدية أو البالغة Somatic stem cell or Adult stem cells :
هي خلايا غير متخصصة و توجد بين الخلايا المتمايزة في الجسم كلّه بعد التطور. و تتمثل وظيفة هذه الخلايا في تمكين الشفاء و النمو و استبدال الخلايا التي يتم فقدانها كل يوم. تحتوي هذه الخلايا على طيف محدود من خيارات التمايز. نذكر من أنواعها ما يلي:
- الخلايا الجذعية الميزنشيمية (الوسيطية) : Mesenchymal Stem cells
و هي خلايا نسيجية متعددة القدرة و التي بإمكانها أن تنقسم إلى أنواع مختلفة من الخلايا. تتمايز هذه الخلايا بشكل رئيسي إلى الخلايا الدّهنية و العظام و الغضاريف و العضلات.
- الخلايا العصبية:
تعطي الأعصاب و الخلايا الدّاعمة لها (الخلايا الدّبقية قليلة التّغصن و الخلايا النّجمية).
- الخلايا الجذعية المكونة للدم:
تشمل جميع أنواع خلايا الدّم (الحمراء, البيضاء و الصّفيحات)
- الخلايا الجذعية الجلدية:
الخلايا الكيراتينية تشكل طبقة واقية لحماية الجلد.
استخدام الخلايا الجذعية في الطّب:
الخلايا الجذعية لديها إمكانات كبيرة لتصبح واحدة من أهمّ الجوانب في الطب التجديدي فعندما تدخل الإشارات إلى الخلية و تبدأ عملية التّمايز يتم إيقاف الجينات التي لم يَعد هناك حاجة إليها و تبقى الجينات المطلوبة المتخصصة للوظيفة نشطة كما يمكن تحقيق تعدد القدرات من خلال التفاعل في تسلسل الجينات.
- زراعة الخلايا الجذعية المُكوّنة للدّمHSC :
تعتبر الخلايا الجذعية المكونة للدم مُهمة لكونها الأكثر تميزاً بالأنسجة، تعد عملية زرعها من أشهر طرق العلاج بالخلايا الجذعية و عادةً ما تكون الخلايا المُستهدفة من نقي العظم ,الدم المحيطي و دم الحبل السري [1] و هذه العملية قد تكون autologous عند استخدام خلايا المريض نفسه أو allogenic عندما تكون الخلايا الجذعية من متبرع أو syngenic عندما تكون من توأم متطابق. وهي مسؤولة عن توليد كل الأنماط الوظيفية المكونة للدم Hematopoietic Stem Cell (HSC) و الصفيحات الدموية تحل زراعتها المشكلات الناتجة عن خلل في أداء نظام الدم مثل: أمراض سرطان الدم و فقر الدم.
- تجديد برمجة الخلايا:
الشيخوخة هي عملية جينية قابلة للعكس تتصف الخلايا المأخوذة من المسنين بأنها تعرضت لمستويات عالية من الإجهاد التأكسدي و اضطرابات بوظيفة الميتوكوندريا و توليميرات أقصر مقارنة بخلايا الشباب.[2] حيث أن هناك فرضية أنه عندما يتم إعادة برمجة الخلايا الجسدية البشرية أو الفأرية البالغة إلى Induced pluripotent stem cells (IPSC) فإن عمرها اللّاجيني يعود إلى الصّفر[3]. فهو أول نهج سريري وُضع كان وقائياً يركز على إيقاف أو إبطاء معدل الشيخوخة.
- أمراض الخصوبة:
في عام 2011 قام الباحثان [4] Hayashi and Katsuhiko بتجربة على الفئران لتشيكل نطاف من IPSC و نجحا بالحصول على فأرين يتمتعان بخصوبة و صحة جيدة التي كانت مصابة بالعقم، كما نجحت التجربة بتشكيل بيوض عند الإناث و المجموعة المستهدفة هي البالغون المعرضون لإصابات لخطر فقدان الخلايا الجذعية المنوية Spermatogenic Stem Cell (SSC) من مرضى السرطان و غيرهم حيث يتم تجميد أنسجة الخصية و تخزينها.[5] كما يمكن استخدام الخلايا الجذعية بحالات العقم عند النساء أو مشاكل المبيض بعد السرطان.
- علاج الأمراض التنكسية العصبية الغير قابلة للشفاء :
بفضل العلاج بالخلايا الجذعية ليس فقط في تأخير تطور الأمراض التنكسية مثل: (باركينسون – الزهايمر – هنتنغتون) بل أيضاً إزالة مصدر المشكلة فهي قادرة على تحسين الوظيفة المعرفية و يمكن توليد الخلايا العصبية الدوبامينية بكفاءة من Human Embryonic Stem Cells (HESCS) فمرض باركينسون هو مرض مثالي للعلاج الخلوي القائم على IPSC و مع ذلك لايزال هذا العلاج في المرحلة التجريبية.[6] فقد تم استخدام أنسجة دماغ من أجنّة مُجهضة على مرضى يعانون من باركينسون فأظهرت العلاجات بالخلايا الجذعية أنه قابل للتحقيق.[7]
- الخلايا الجذعية كبديل عن رأب المفصل Arthroplasty:
تم استخدام الخلايا الجذعية لعلاج:
- مشاكل الأوتار عند الرياضيين[8] ، التهاب العظام [9] OA، تنخر العظم الوركي الفخذي ONFH هو مرض Refractory مرتبط مع هبوط رأس الفخذ و خطر إصلاح مفصل الورك عند اليافعين[10] كما أظهرت أغلب الدراسات السريرية على علاجه بالخلايا الجذعية نتائج إيجابية مع تقليل الألم وتحسين الوظيفة. [11 – 12 ]
- الخلايا الجذعية و بنوك الأنسجة:
يمكن تخزين الخلايا الجذعية في بنوك الأنسجة لتكون مصدراً أساسياً للأنسجة البشرية المستخدمة في الفحص الطبي و مشكلة خلايا الأنسجة المتمايزة التقليدية المحتفظ بها في المخبر تتناقص قدرتها على التّمايز بمرور الوقت على عكس IPSC معروف أَّنَّ الحبل السري غني بالخلايا الجذعية التي يمكن حفظها بالتبريد مباشرةً بعد الولادة و تخزينها لاستخدامها لاحقاً في علاج الامراض المهددة للحياة و من مصادرها أيضاً قشرة الأسنان المتساقطة البشرية Stem Cells from Human Exfoliated Deciduous Teeth (SHED) حيث أن تقنيات جمعها و عزلها و تخزينها بسيطة.
التّحديات حول العلاج بالخلايا الجذعيّة:
على الرغم من أن الخلايا الجذعية تبدو حل مثالي للطب التجديدي لا يزال يوجد العديد من العقبات التي تحتاج لتخطّيها في المستقبل.
- المشكلة الأولى: هي الخلافات الأخلاقية.
Embryonic Stem Cells (ESCS) هي الخلايا الجذعية وافرة القدرات الأكثر شيوعاً. فإن العلاجات باستخدام هذه الخلايا كانت و لا تزال مصدر للخلافات الأخلاقية بسبب استئصال ESC من الأجنة البشرية حيث أن العلاج بها يبدو فعالاً جداً للعديد من الأمراض الغير قابلة للعلاج, لهذا السبب رأى العلماء أنه يمكن العلاج بهذه الطريقة مركّزين جهودهم بجعلها مُمكنة العزل بدون تعريض مصدرها للخطر .
- المشكلة الثانية: الحصول على تحمُّل مناعي ناجح بين الخلايا الجذعية و جسم المريض و حتى الآن يوجد اهتمام حول إمكانية الحصول عليها بدون خطر الاعتلال أو الألم لكل من المريض و المتبرع. [13]
واحدة من الجدالات التي حدَّت من استخدام IPSC هو دورها السلبي في تشكيل الأورام. حيث يزداد خطر تشكل الأورام عندما يتم إعادة برمجة الخلايا . ففي عام 2008 تم اكتشاف تقنية سمحت للعلماء بإزالة الجين المسرطن بعد الحصول على خلية وافرة القدرات و على الرغم من أنها غير فعالة إلا أنّها استغرقت وقتاً طويلاً . و قد أمكن تحفيز عملية إعادة البرمجة بحذف الجين الكابح للورم p53 لكن هذا الجين يعمل كمفتاح منظم للسرطان الذي يجعل من المستحيل إزالته ليتم تجنب الطفرات في الخلايا المعاد برمجتها. كما أن قلَّة فعالية هذه العملية من المشاكل الأخرى التي حدّت من استخدامها مع تقدم السنوات. ففي دراسة Yamanka كان معدل الخلايا الجسمية المعاد برمجتها حتى 0.1% . و قد خلق استخدام عوامل النسخ لإدخال الجينات على جينوم الخلية المستهدفة خطراً لحدوث الطفرات .لذلك فالعملية الأخلاقية المقبولة حتى الآن لتقييم صفة الخلايا وافرة القدرات هي حقن hEsc في أجنة الفئران. [14]
العقبات التي تواجهها الخلايا الجذعية في المستقبل:
يجب فهم كامل الآلية التي تعمل بها الخلايا الجذعية في النماذج الحيوانية. فالرفض المناعي هو عائق أمام نجاح عملية الزرع للخلايا الجذعية حيث أن الجهاز المناعي يتعرف على الأجسام المزروعة على أنها أجسام غريبة مما يؤدي إلى رفض الزرع . فلهذا السبب ، أصبحت بنوك الأنسجة تحظى بشعبية من خلال الاحتفاظ بالخلايا و جعلها مصدر للطب التجديدي مما تتيح القدرة على استخدام خلايا المريض نفسه و بفضلها أصبح بالإمكان إطالة عمر الانسان.
فهل ستنجح الخلايا الجذعية بتجاوز تلك العقبات لتصبح علاجاً معترفاً لأمراض عجز الطب حيالها…. ربما!
المراجع:
- Rocha V, et al. Clinical use of umbilical cord blood hematopoietic stem cells.Biol Blood Marrow Transplant. 2006;12(1):34–4.
- Sahin E, Depinho RA. Linking functional decline of telomeres, mitochondria and stem cells during ageing. Nature. 2010;464:520–8.
- Petkovich DA, Podolskiy DI, Lobanov AV, Lee SG, Miller RA, Gladyshev VN.Using DNA methylation profiling to evaluate biological age and longevity interventions. Cell Metab. 2017;25:954–60 https://doi.org/10.1016/j.cmet.2017.03.016.
- Hayashi K, Ohta H, Kurimoto K, Aramaki S, Saitou M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells.Cell. 2011;146(4):519–32. https://doi.org/10.1016/j.cell.2011.06.052.
- Sadri-Ardekani H, Atala A. Testicular tissue cryopreservation and spermatogonial stem cell transplantation to restore fertility: from bench to bedside. Stem Cell ResTher. 2014;5:68
- Peng J, Zeng X. The role of induced pluripotent stem cells in regenerativemedicine: neurodegenerative diseases. Stem Cell ResTher. 2011;2:32. https://doi.org/10.1186/scrt73.
- Wright BL, Barker RA. Established and emerging therapies for Huntington’sdisease. 2007;7(6):579–87 https://www.ncbi.nlm.nih.gov/pubmed/17896994/57987.61. Shi S, Bartold PM, Miura M, Seo BM, Robey PG, Gronthos S. The efficacy ofmesenchymal stem cells to regenerate and repair dental structures.OrthodCraniofac Res. 2005;8:191–9.
- Longo UG, Ronga M, Maffulli N. Sports Med Arthrosc 17:112–126. Achilles tendinopathy. Sports Med Arthrosc. 2009;17:112–26.
- Tempfer H, Lehner C, Grütz M, Gehwolf R, Traweger A. Biological augmentation for tendon repair: lessons to be learned from development,disease, and tendon stem cell research. In: Gimble J, Marolt D, Oreffo R, RedlH, Wolbank S, editors. Cell engineering and regeneration. Reference Series in Biomedical Engineering. Cham: Springer; 2017.
- Li R, Lin Q-X, Liang X-Z, Liu G-B, et al. Stem cell therapy for treating osteonecrosis of the femoral head: from clinical applications to related basic research. Stem Cell Res Therapy. 2018;9:291 https://doi.org/10.1186/s13287-018-1018-7.
- Gangji V, De Maertelaer V, Hauzeur JP. Autologous bone marrow cell implantation in the treatment of non-traumatic osteonecrosis of the femoral head: five year follow-up of a prospective controlled study. Bone.2011;49(5):1005–9
- Sen RK, Tripathy SK, Aggarwal S, Marwaha N, Sharma RR, Khandelwal N.Early results of core decompression and autologous bone marrow mononuclear cells instillation in femoral head osteonecrosis: a randomized control study. J Arthroplast. 2012;27(5):679–86.
- Harris MT, Butler DL, Boivin GP, Florer JB, Schantz EJ, Wenstrup RJ. Mesenchymal stem cells used for rabbit tendon repair can form ectopic bone and express alkaline phosphatase activity in constructs. J Orthop Res. 2004;22:998–1003.
- Mascetti VL, Pedersen RA. Human-mouse chimerism validates human stem cell pluripotency. Cell Stem Cell. 2016;18:67–72.
-
شارك
-
شارك
-
شارك
الجامعة الوطنية الخاصة
مواقع مرتبطة:
للتواصل :
- سوريا - محافظة حماة - الطريق الدولي حمص حماة
- 0096334589094
- 00963335033
- info@wpu.edu.sy