الـواحــة الطلابيــة للجـامعــة الوطنيــة الخـاصــة
Student Oasis of Al-Wataniya Private University
عنوان الحلقة البحثية : ولد الفقاعة The Boy in The Bubble
مسابقة أفضل حلقة بحثية طلابية - كلية الصيدلة -

الأستاذ المشرف
الدكتورة طلة المللي

اعداد الطالبة
ولاء معمر المنصور

اعداد الطالبة
هند علي الشدة
- مسابقة أفضل حلقة بحثية طلابية
- طب الأسنان
- الصيدلة
- الهندسة ( معلوماتية و اتصالات )
- الهندسة المدنية
- هندسة العمارة و التخطيط العمراني
- العلوم الإدارية و المالية

يمكن تشبيه الجسم بقاعدة بيانات أساسها الـحمض الريبي النووي منقوص الأكسجينDNA الذي يحمل تتاليات نكليوتيدية، بعض هذه التتاليات تشكل ما يعرف بالجين والذي بدوره يحمل معلومة وراثية خاصة ببروتين معين أي عندما يتم التعبير عن هذا الجين سنحصل على بروتين وظيفي يلعب دوراً محدداً في حياة الخلية. ومن الجدير بالذكر فإن أي خلل أو فقدان لهذا الجين يؤدي إلى طفرة أو فقدان للبروتين المقابل وبالتالي سينتج مرض معين. جاءت فكرة العلاج الجيني لتصحيح الخطأ أو تعويض الفقد في جين معين.
إذاً تعتمد فكرة العلاج الجيني على استخدام الأحماض النووية “الجينات” كمركبات طبية علاجيه للأمراض التي لها علاجات محدودة أو ليس لها علاج. و يقصد هنا بالأمراض، الأمراض أحادية الجين mono gene diseases أي الأمراض التي يكون سببها خلل أو طفرة بجين واحد فقط عند إضافة هذا الجين لتعويض الجين الطافر أو المفقود سيؤدي إلى علاج المرض وتحسين حياه المريض .
- المقدمة:
سأبدأ قصتي بسؤال. من منكم اضطر للمكوث في غرفته يوما كاملاً دون الخروج منها؟… الكثيرون منا، لكن ماذا عن يومين؟ ثلاثة.؟ أسبوع؟ شهر؟ سنة؟ سيصبح الأمر مستحيلاً. لكن ماذا لو أخبرتكم بأن هنالك من أمضى اثني عشر عاماً في غرفة بلاستكية عقيمة من نوع خاص. الأمر لا يصدق لكنني هنا سأتحدث عن قصة واقعية حصلت مع الطفل ديفيد فيتر أو كما كان يعرف بـ “ولد الفقاعة”.
ولد ديفيد عام 1971 بمرض وراثي يعرف بالعوز المناعي الشديد والمترافق Severe Combined Immuno Deficiency الذي يؤدي إلى غياب فعالية الجملة المناعية لدى المريض بذراعيها الخلوي cellular والخلطي humoral، مؤدياً إلى سهولة تعرض المريض لإنتانات فيروسية وجرثومية شديدة تكون قاتلة في معظم الأحيان.
كبر ديفيد وترعرع في هذه الفقاعة العقيمة التي صممتها وكالة ناسا خصيصاً له الشكل (1) وعندما بلغ الثانية عشرة من عمره قام طبيبه بإجراء عملية زرع نقي عظم أخذ من أخته. لكن على ما يبدو عند إجراء العملية تمكنت إحدى أنواع الجراثيم من التسلل إلى جسمه وتسببت له بإنتانات في الجهاز التنفسي أودت بحياته[1].

إنّ هذه القصة المحزنة وغيرها من القصص المشابهة و التي يعود سببها لخلل في جين ما، دفعت العلماء في الثمانينات إلى التوجه لاستراتيجية علاجية جديدة لمثل هذا النوع من الأمراض ومن هنا بدأت فكرة “العلاج الجيني” بالنمو و الازدهار.
- العلاج الجيني
يمكن تشبيه الجسم بقاعدة بيانات أساسها الـحمض الريبي النووي منقوص الأكسجينDNA الذي يحمل تتاليات نكليوتيدية، بعض هذه التتاليات تشكل ما يعرف بالجين والذي بدوره يحمل معلومة وراثية خاصة ببروتين معين أي عندما يتم التعبير عن هذا الجين سنحصل على بروتين وظيفي يلعب دوراً محدداً في حياة الخلية. ومن الجدير بالذكر فإن أي خلل أو فقدان لهذا الجين يؤدي إلى طفرة أو فقدان للبروتين المقابل وبالتالي سينتج مرض معين. جاءت فكرة العلاج الجيني لتصحيح الخطأ أو تعويض الفقد في جين معين.
إذاً تعتمد فكرة العلاج الجيني على استخدام الأحماض النووية “الجينات” كمركبات طبية علاجيه للأمراض التي لها علاجات محدودة أو ليس لها علاج. و يقصد هنا بالأمراض، الأمراض أحادية الجين mono gene diseases أي الأمراض التي يكون سببها خلل أو طفرة بجين واحد فقط عند إضافة هذا الجين لتعويض الجين الطافر أو المفقود سيؤدي إلى علاج المرض وتحسين حياه المريض .
ويجدر التنويه إلى أنه حينما نقول علاج جيني فهذا يعني أن هنالك العديد من الجوانب التي يجب مراعاتها نذكر منها:
- تحديد الجين اللازم للعلاج.
- فهم المرض بشكل جيد جداً لنستطيع تكوين فكرة هل هذا المرض ناتج من فقد هذا الجين فقط أو بعبارة أخرى هل تعويض هذا الجين سينهي المرض أم هنالك أبعاد أخرى وأمور أخرى تشارك بهذا المرض وهذه النقطة هامة جداً لأن الوصول للعلاج الجيني عمل شاق ومتعب وطويل ويواجه الكثير من التحديات وبالتالي يجب في نهاية المطاف ان يحقق الهدف المرجو.
١.٢ أساليب العلاج الجيني:
تقسم العلاجات الجينية إلى نوعين.
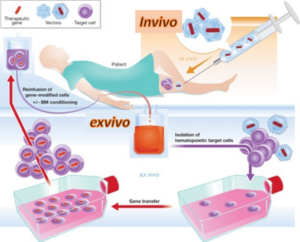
١.١.٢ المعالجة الجينية داخل الجسم in vivo gene therapy : ويجري خلالها حقناً مباشراً لناقل الجين العلاجي (كالفيروس مثلاً) ضمن الكائن الحي الذي يعدي الخلايا بشكل مباشر، ويجري التعبير عن الجين المنقول ضمن الخلايا المستهدفة بالفيروس كما هو موضح في الشكل (2).
٢.١.٢ المعالجة الجينية خارج الجسم ex vivo gene therapy : تتضمن هذه المعالجة إخراج خلايا محددة من المريض وإكثارها في المختبر ومن ثم إعداءها بالفيروس المعدل جينياً ثم إعادة الخلايا المعدلة جينياً إلى المريض والتي ستقوم بالتعبير عن الجين المدخل داخل العضوية كما هو موضح في الشكل (2).
أشرت آنفاً إلى مصطلح الناقل Vector ، سنتعرف عليه في الفقرة الآتية.
٢.٢ النواقل Vectors:
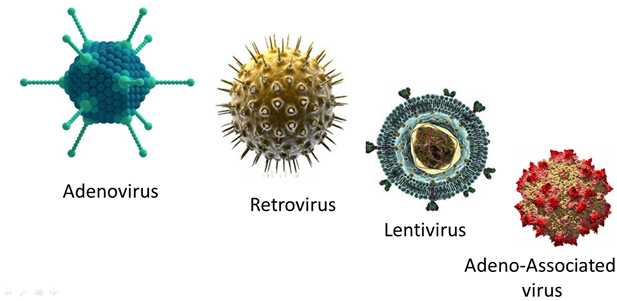
يلعب الناقل دوراً هاماً في نقل الجين العلاجي إلى الخلايا الهدف. يعرض الشكل (3) بعض أنواع النواقل، وعادة مايتم تصنيف النواقل الى:
١.٢.٢ نواقل فيروسية viral vectors : الفيروسات القهقرية (retrovirus)، فيروسات غدية (adeno-Associated virus)
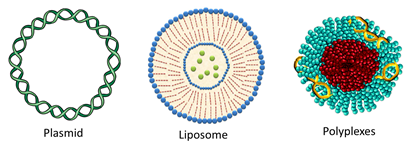
٢.٢.٢ نواقل غير فيروسية non- viral vector مثل البلاسميد (plasmid)، الجسيمات الدهنية (liposome)، الجسيمات النانوية (polyplex)
بالطبع لا نستطيع إدخال عامل ممرض إلى جسم الإنسان ولكن الفيروس المستخدم بالعلاج الجيني هو فيروس معدل باستخدام الهندسة الوراثية أي تم التخلص من الجينات العدوانية كالجينات المسؤولة عن التهرب من جهاز المناعة ومن ثم ندخل الجين ضمن الفيروس ويتم إدخاله للخلايا الهدف.
علما بأنه أياً كان نوع الناقل المستخدم لا بد أن يحقق شرطين أساسيين:
- يجب أن يكون قادراً على نقل الجين للخلية الهدف بكفاءة عالية.
- ألا يحفز جهاز استجابة مناعية ضد المضيف.
٣.٢ الأمراض المستهدفة في العلاج الجيني
بعد تحديد الخريطة الجينية واكتشاف الآلية الإمراضية لجميع الأمراض تبين أنها ترتبط بالمجمل بطفرات بالمادة الوراثية، و تعتبر السرطانات أكثرها انتشاراً . لذلك نجد أن 65% من الدراسات السريرية وأبحاث العلاج الجيني تصب في صالح الأمراض السرطانية بالإضافة لكونها أكثر جدوى اقتصادية خاصة أن دراسات العلاج الجيني مكلفة جداً. تليها الأمراض أحادية الجين 11.1%. وعلى الرغم من ارتفاع التكلفة وصعوبة تطوير مثل هذا النوع من العلاجات إلا أن هنالك عدداً من العلاجات الجينية استطاعت تخطي العتبة والانتقال من التجارب البحثية السريرية إلى علاجات في متناول المرضى من عامة الناس، وهي:
- الادوية الجينية
الأدوية الجينية هي أدوية مصممة لتعديل الجينوم البشري، وهي تمثل مجالًا ناشئًا سريعًا في الطب. تُستخدم الأدوية الجينية حالياً لعلاج مجموعة متنوعة من الأمراض، بما في ذلك السرطان وأمراض القلب والأوعية الدموية والأمراض الوراثية.
١.٣الأدوية الجينية المستخدمة لعلاج مرض السرطان
تمثل الأدوية الجينية أحد أكثر المجالات الواعدة في علاج السرطان. تستهدف هذه الأدوية الجينات المسببة للسرطان أو تُستخدم لتعزيز قدرة الجهاز المناعي على محاربة السرطان. وفيما يلي أمثلة لبعض الأدوية المستعملة:
- Gendicin : يستخدم هذا الدواء لعلاج سرطان الرأس والعنق الظهاري عن طريق إدخال جين يمنع نمو الخلايا السرطانية[٢].
- Kymriah : يستخدم هذا الدواء كخط علاج ثاني لمرضى سرطان اللمفاويات البائية الحاد (ALL) (للأطفال) والذين أبدوا انتكاساً بعد العلاجات التقليدية. وهو يعمل عن طريق تعديل الخلايا الليمفاوية للمريض ليكون لها القدرة على محاربة الخلايا السرطانية[٣].
- :Yescarta يستخدم هذا الدواء كخط علاج ثاني لمرضى سرطان اللمفاويات البائية الحاد (ALL) (للكبار) والذين أبدوا انتكاساً بعد العلاجات التقليدية. وهو يعمل بنفس طريقة Kymriah[٤].
- Imlygic: يستخدم هذا الدواء لعلاج سرطان الخلايا الميلانينية (Melanoma) عن طريق إدخال جين يحث الخلايا السرطانية على إنتاج بروتين يقتل الخلايا السرطانية. [٥]
٢.٣العلاج الجيني الموجه لعلاج أمراض الجهاز القلبي الوعائي
يُعد العلاج الجيني الموجه مجالًا ناشئاً آخر في علاج أمراض الجهاز القلبي الوعائي. تستهدف هذه الأدوية الجينات المسببة لأمراض القلب والأوعية الدموية أو تُستخدم لتعزيز قدرة الجسم على إصلاح الأوعية الدموية التالفة. وفيما يلي أمثلة لبعض الادوية المستعملة:
- Neovasculgen:يستخدم هذا الدواء لعلاج نقصان التروية الدموية بالأطراف (Critical Limbic Ischemia) عن طريق تحفيز نمو الأوعية الدموية الجديدة[6].
٣.٣الأدوية الجينية الأخرى
هناك العديد من الأدوية الجينية المستخدمة لعلاج أمراض وراثية سببها طفرة في جين معين منها :
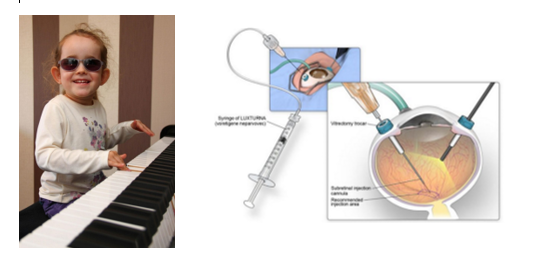
أ- (Luxturna (Voretigene neparvovec: يستخدم في فقدان البصر الوراثي الخلقي (Leber’s Congenital Amaurosis) الناتج عن طفرة بجين RPE65 ، [٧] الشكل (5):
ب- Zolgensma: يستخدم لعلاج الضمور النخاعي الشوكي ، للأطفال المصابين الذين تقل أعمارهم عن عامين[٨].
بالإضافة إلى كل ما تم ذكره سابقاً هنالك العديد من الأدوية الأخرى والكثير في طور الدراسة [٩]. من أهم الأمراض الوراثية التي تُستهدَف اليوم بالمعالجات الجينية : التليف الكيسي ، الحثل العضلي، الناعور ، العمى الخَلْقي أو فقدان البصر الوراثي ، إضافة لذلك تستهدف المعالجة الجينية بعض الأمراض المكتسبة كالسرطان والأمراض التنكسية العصبية والإيدز والتهاب الكبد.
بالعودة لقصة ولد الفقاعة، لا بد من الإشارة إلى أن أول علاج جيني تم إنتاجه استهدف علاج العوز المناعي الشديد و المترافقSCID . حيث تمّ إدخال جين ADA السليم في أحد الفيروسات القهقرية Retroviruses وتم إعداء عشرة من الأطفال المرضى بالفيروس المعدل وراثياً وبعد عدة أشهر ظهرت النتائج المشجعة جداً. حيث أن 9 من أصل 10 من الأطفال المعالجين قد تحسنت الاستجابة المناعية لديهم تجاه العوامل الممرضة . فقد قام هذا العلاج الجيني بتشفير أنزيم يدعى: adenosine deaminase (ADA) الضروري لنضج الكريات البيضاء والذي يفتقر له هؤلاء المرضى. وبدا أن حقل المعالجة الجينية أخذ بالازدهار ولكن ولسوء الحظ بعد ثلاثة سنوات تطور لدى 3 من الأطفال ابيضاضات دم سرطانية اتضح فيما بعد أن معظمها نتج عن انغراس مجين الفيروس القهقري المستخدم كناقل فيروسي بقرب بعض الجينات المولدة للورم Oncogens في مجائن المرضى وتفعيلها لتلك الجينات الأمر الذي أدى إلى تطور السرطانات لديهم. تم شفاء اثنان من هؤلاء الثلاثة بعد تعريضهم بشكل كبير لعلاجات كيماوية للقضاء على السرطان فيما توفي الطفل الثالث. مما تسبب بوقف استخدام هذا العلاج الجيني بالرغم من أن التسعة أطفال تابعوا حياتهم فيما بعد بشكل طبيعي [١٠].
- الخاتمة
لا يزال هذا العلاج يحمل معه الكثير من الآمال وتسارع وتيرة نجاح بعض هذه العلاجات في الآونة الأخيرة جعلت الأنظار تتجه نحوه من جديد فهل سنشهد قريباً المزيد من المفاجآت الجميلة بهذا الصدد…..ربّما!
المراجع
- IDF: Immune Deficiency Foundation. https://primaryimmune.org/resources/news-articles/story-david-vetter. Accessed on : 04/01/2024
- Zhang WW, Li L, Li D, Liu J, Li X, Li W, Xu X, Zhang MJ, Chandler LA, Lin H, Hu A, Xu W, Lam DM. The First Approved Gene Therapy Product for Cancer Ad-p53 (Gendicine): 12 Years in the Clinic. Hum Gene Ther. 2018 Feb;29(2):160-179.
- Rakesh Awasthi, Harald J. Maier, Jie Zhang & Stephen Lim (2023) Kymriah® (tisagenlecleucel) – An overview of the clinical development journey of the first approved CAR-T therapy, Human Vaccines & Immunotherapeutics, 19:1, DOI: 10.1080/21645515.2023.2210046
- AlDallal SM. Yescarta: A New Era for Non-Hodgkin Lymphoma Patients. Cureus. 2020 Nov 16;12(11):e11504.
- O’Donoghue C, Doepker MP, Zager JS. Talimogene laherparepvec: overview, combination therapy and current practices. Melanoma Manag. 2016 Dec;3(4):267-272.
- Deev R, Plaksa I, Bozo I, Mzhavanadze N, Suchkov I, Chervyakov Y, Staroverov I, Kalinin R, Isaev A. Results of 5-year follow-up study in patients with peripheral artery disease treated with PL-VEGF165 for intermittent claudication. Ther Adv Cardiovasc Dis. 2018 Sep;12(9):237-246.
- Gao J, Hussain RM, Weng CY. Voretigene Neparvovec in Retinal Diseases: A Review of the Current Clinical Evidence. Clin Ophthalmol. 2020 Nov 13;14:3855-3869.
- Ogbonmide T, Rathore R, Rangrej SB, Hutchinson S, Lewis M, Ojilere S, Carvalho V, Kelly I. Gene Therapy for Spinal Muscular Atrophy (SMA): A Review of Current Challenges and Safety Considerations for Onasemnogene Abeparvovec (Zolgensma). Cureus. 2023 Mar 15;15(3):e36197.
- Fatemeh Arabi, Vahid Mansouri, Naser Ahmadbeigi,Gene therapy clinical trials, where do we go? An overview,Biomedicine & Pharmacotherapy,Volume 153,2022,
- Kumar SR, Markusic DM Biswas M, High KA, Herzog RW. Clinical development of gene therapy: results and lessons from recent successes. Mol Ther Methods Clin Dev. 2016 May 25;3:16034.
-
شارك
-
شارك
-
شارك
الجامعة الوطنية الخاصة
مواقع مرتبطة:
للتواصل :
- سوريا - محافظة حماة - الطريق الدولي حمص حماة
- 0096334589094
- 00963335033
- info@wpu.edu.sy