الـواحــة الطلابيــة للجـامعــة الوطنيــة الخـاصــة
Student Oasis of Al-Wataniya Private University
عنوان الحلقة البحثية : مقاومة الأنسولين والتمثيل الغذائي
مسابقة أفضل حلقة بحثية طلابية - الصيدلة -

الأستاذ المشرف
د. عبد الكريم مغمومة

اعداد الطالبة
هناء هيثم النجار
- مسابقة أفضل حلقة بحثية طلابية
- طب الأسنان
- الصيدلة
- الهندسة ( معلوماتية و اتصالات )
- الهندسة المدنية
- هندسة العمارة و التخطيط العمراني
- العلوم الإدارية و المالية
الملخص :
يُشير مصطلح مقاومة الإنسولين إلى وجود استجابة بيولوجية ضعيفة إما للإنسولين المعطى خارجياً أو المفرز داخلياً. وتتجلى مقاومة الإنسولين من خلال انخفاض نقل الغلوكوز المحفز بالإنسولين والتمثيل الغذائي في الخلايا الشحمية والعضلات الهيكلية وضعف تثبيط الإنسولين لتحلل الدهون في الخلايا الشحمية وإنتاج الغلوكوز الكبدي، وسنستعرض في هذا البحث تأثير مقاومة الإنسولين على متلازمة التمثيل الغذائي.
الكلمات المفتاحية : الإنسولين– متلازمة التثميل الغذائي – الرياضة .
مقاومة الإنسولين Insulin Resistance:
تُعرّف مقاومة الإنسولين على أنّها الاستجابة البيولوجية الضعيفة للأنسجة المستهدفة لتحفيز الإنسولين، ويمكن أن تصبح جميع الأنسجة التي تحتوي على مستقبلات الإنسولين مقاومةً له، ولا سيما الكبد والعضلات الهيكلية والأنسجة الدهنية.
تُعيق مقاومة الإنسولين التّخلص من الغلوكوز، مما يؤدّي إلى زيادة تعويضية في إنتاج الإنسولين من خلايا بيتا وفرط إنسولين الدم، والذي يعدّ بحد ذاته المحرّك لمقاومة الإنسولين. وتشمل العواقب الاستقلابية لمقاومة الإنسولين ارتفاع السكر في الدم، ارتفاع ضغط الدم، اضطراب شحوم الدم، فرط حمض البول في الدم، ارتفاع المؤشؤات الالتهابية، خلل بطانة الأوعية الدموية وحوادث خثارية، ويمكن أن يؤدي تطور مقاومة الإنسولين إلى متلازمة التمثيل الغذائي، ومرض الكبد الدهني غير الكحولي (NAFLD)، ومرض السكري من النمط الثاني.[1][2][3][4][5]
أسباب مقاومة الإنسولين Insulin Resistance Etiologies:
الأسباب المكتسبة لمقاومة الإنسولين :
- زيادة السمنة الحشوية المرتبطة بترسب الدهون خارج الرحم والفائض من مخازن الدهون تحت الجلد.
- الخمول البدني.
- الأدوية (الغلوكوكورتيكويدات، المضادات الأدرينرجية، مثبطات البروتياز، مثبطات إعادة التقاط السيروتونين الانتقائية، مضادات الذهان غير التقليدية، والإنسولين الخارجي)
الأسباب الوراثية لمقاومة الإنسولين :
- الضمور العضلي
- الحثل الدهني
- متلازمة المبيض المتعدد الكيسات [6].
نقل الإنسولين Insulin Signaling:
تبدأ إشارات الإنسولين من خلال ربط وتنشيط مستقبله على سطح الخلية وتبدأ سلسلة من أحداث الفسفرة ونزع الفسفرة، وتوليد المرسال الثاني، وتفاعلات بروتين- بروتين التي تؤدي إلى أحداث استقلابية متنوعة في كل الأنسجة تقريباً.
يتكون مستقبل الأنسولين من تحت وحدتين فرعيتين α مرتبطتين بالإنسولين وتحت وحدتي β فرعيتين نشطتين تحفيزياً ترتبطان بثنائي كبريتيد في معقد α2β2 متغاير القسيمات. ويرتبط الإنسولين بأحد وحدات α الفرعية خارج الخلية، مما يؤدي إلى تنشيط مجال التيروزين كيناز داخل الخلوي لتحت الوحدة الفرعية β. تقوم تحت الوحدة β الفرعية بفسفرة نظيرتها على ثمالات تيروزين محددة قد يكون لها وظائف متميزة مثل تحفيز الارتباط بين الجزيئات لجزيئات الإشارة مثل (Growth factor recepyor bound protein) Grb، IRS1 إلى IRS4 Insulin receptor substrate) ركيزة مستقبل الإنسولين) ، وأفراد عائلة SIRP (بروتين تنظيم الإشارة signal-regulatory protein) Gab-1 GRB2 Associated Binding Protein 1)) ، (Colicin-B immunity protein) Cbl، CAP (catabolite activator protein) ، والبروتين المحول (Adopter Protein) APS تحفيز الانقسام ؛ واستيعاب المستقبلات [7].
يبدأ الطريق الاستقلابي لإشارات الإنسولين بواسطة IRS [8]. وتضمن هذه المسارات معاً النقل الفعال لناقل الجلوكوز من النوع 4 Glucose Transporter type 4 (GLUT4) إلى الغشاء. والذي يتمتع بجاذبية عالية للغلوكوز، ويتم التعبير عنه في خلايا العضلات والخلايا الشحمية.]9 .
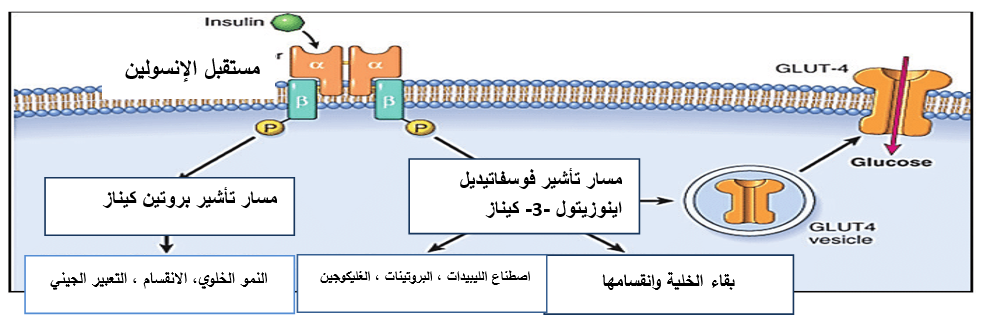
الشكل رقم (1) : رسم تخطيطي لمسارات إشارات الإنسولين. عند تحفيزه بواسطة الإنسولين، يقوم مستقبل الأنسولين باستخدام وفسفرة بروتينات IRS التي تتوسط تنشيط مسار إشارات تيروزين كيناز PI3K/ TYK ومسار إشارات MAP كيناز. يتوسط مسار PI3K/TYK العمل الاستقلابي للإنسولين بما في ذلك تكوين الدهون، وتشكيل الغليكوجين، واصطناع البروتين. كما أنه يحفز نقل ناقلات الجلوكوز (مثل GLUT4) إلى سطح الخلية وهو أمر بالغ الأهمية لامتصاص الغلوكوز بواسطة الأنسجة الحساسة للإنسولين مثل العضلات الهيكلية والدهون. يتواسط مسار كيناز MAP نمو الخلايا وانتشارها وتنظيم التعبير عن الجينات المختلفة في الخلايا المستجيبة للإنسولين.
آليات مقاومة الإنسولين Insulin Resistance Mechanisms:
يقوم البنكرياس بالتعويض في المراحل المبكرة من مقاومة الإنسولين، عن طريق زيادة إفراز الإنسولين في مجرى الدم في محاولة للتغلب على الخلل في عمل الإنسولين المحيطي. واستجابةً لهذه الحاجة المتزايدة على إنتاج الإنسولين، تضخم خلايا بيتا. وفي ظل ظروف الصيام، يكون التعويض الأساسي كافياً للحفاظ على نسبة الغلوكوز في الدم ضمن المعدل الطبيعي. ومع ذلك، بعد تناول الوجبة، عندما يتم امتصاص الغلوكوز بسرعة من القناة الهضمية، يحدث نقص نسبي في الإنسولين بسبب عدم كفاية التعويض [10].
إنّ المواقع الثلاثة الرئيسية لمقاومة الإنسولين هي: العضلات الهيكلية والكبد والأنسجة الدهنية. وفي حالة فائض السعرات الحرارية المزمن، تصبح أنسجة الجسم مقاومة لإشارات الإنسولين. وتُعدَ العضلات الهيكلية عبارةً عن خزان كبير لتدوير الغلوكوز، وهو ما يمثَل ما يصل إلى 70% من التخلص من الغلوكوز.
إنّ النتيجة المباشرة لمقاومة الإنسولين في العضلات هي انخفاض امتصاص الغلوكوز عن طريق الأنسجة العضلية. ويتم تحويل الغلوكوز من العضلات إلى الكبد، حيث يحدث تكوين الدهون الجديد de novo lipogenesis (DNL). ومع زيادة ركيزة الغلوكوز، يطوّر الكبد مقاومة للإنسولين أيضاً. وتزيد المعدلات المرتفعة من DNL من محتوى الشحوم الثلاثية في البلازما وتخلق بيئة من ركيزة الطاقة الزائدة، مما يزيد من مقاومة الإنسولين في جميع أنحاء الجسم، ويساهم في ترسب الدهون في الأعضاء الحشوية وحولها [11].
- أنسجة العضلات الهيكلية :
بعد تناول السعرات الحرارية وتحويلها إلى غلوكوز، تصبح العضلات الموقع الرئيسي للتخلص من الغلوكوز، وهو ما يمثل ما يصل إلى 70% من امتصاص الجلوكوز في الأنسجة. وفي حالة زيادة السعرات الحرارية المزمنة، تراكم الأنسجة العضلية الأحماض الدهنية داخل الخلايا. ويشير Diacylglycerol وهو -حمض دهني داخل الخلايا – إلى زيادة الطاقة داخل الخلية، ويقلل من إشارات الأنسولين القريبة. وتكون النتيجة المباشرة انخفاض ناقل الغلوكوز من النوع 4 (GLUT4) إلى غشاء الخلية وتقليل امتصاص الغلوكوز بواسطة الأنسجة العضلية. ويتم تحويل الزائد منه في الدم إلى الكبد ليتم استقلابه أو تخزينه [12][11].
- الأنسجة الكبدية :
يعدَ الكبد مسؤولاً عن معالجة ركائز الطاقة، فهو يقوم بتعبئة وإعادة تدوير وتصنيع الأحماض الدهنية وتخزين وتصنيع الغلوكوز. وإذا أصبح الكبد مقاوماً للإنسولين، تتأثر هذه العمليات بشدة، مما يؤدي إلى اضطرابات استقلابية كبيرة. عندما تصاب العضلات الهيكلية بمقاومة الأنسولين، يتم تحويل الجلوكوز الزائد في الدم إلى الكبد. وعندما تستشعر أنسجة الكبد وجود فائض من ركيزة الطاقة، خاصةً في شكل ثنائي الجلسريد، تحدث عملية مشابهة لتلك التي تحدث في العضلات الهيكلية [12][11].
وتقل إشارات الإنسولين القريبة في الكبد، ويدخل الغلوكوز الزائد إلى خلايا الكبد عبر مسارات مستقلة عن الإنسولين، مما يحفز DNL عبر دفع الركيزة، مما يخلق المزيد من الأحماض الدهنية من فائض الغلوكوز. وتترسب الأحماض الدهنية الزائدة في الكبد أو على شكل دهون في جميع الأحشاء. بالإضافة إلى ذلك، تساهم التغيرات الالتهابية المناعية في تحلل الدهون الزائدة من الأنسجة الدهنية، والتي يتم إعادة أسترتها بواسطة الكبد وتزيد من انتشار الأحماض الدهنية وترسب الدهون خارج الرحم. أخيراً، يكون التثبيط الطبيعي لتكوين السكر عن طريق الأنسولين مصحوباً بخلل، ويستمر الكبد في إنتاج المزيد من الغلوكوز، مما يزيد من فائض الغلوكوز في الدورة الدموية [11] [12].
- الأنسجة الدهنية :
يعد تحلل الدهون حساساً للإنسولين. ويزيد فشل الإنسولين في تثبيط تحلل الدهون في الأنسجة الدهنية المقاومة للإنسولين، وخاصة الأنسجة الدهنية الحشوية، من انتشار الأحماض الدهنية الحرة (FFAs). وتؤثر المستويات الأعلى من FFAs المنتشرة بشكل مباشر على استقلاب الكبد والعضلات، مما يزيد من تفاقم مقاومة الإنسولين في هذه الأنسجة ويساهم في خلل خلايا بيتا الناجم عن السمية الدهنية [12][11].
أسباب متلازمة التمثيل الغذائي Metabolic Syndrome Etiologies:
تُعدّ متلازمة التمثيل الغذائي تراكماً لعدة اضطرابات، والتي تزيد معاً من خطر إصابة الفرد بأمراض القلب والأوعية الدموية وتصلب الشرايين، مقاومة الإنسولين، وداء السكري، ومضاعفات الأوعية الدموية والعصبية مثل الحدثية الوعائية الدماغية، ويصبح الاضطراب الاستقلابي متلازمةً في حال تحقق ثلاثة مما يلي:
- محيط الخصر أكثر من 40 بوصة عند الرجال و35 بوصة عند النساء.
- ارتفاع مستوى الشحوم الثلاثية 150 ملليجرام لكل ديسيلتر من الدم (ملجم/ديسيلتر) أو أكثر.
- انخفاض نسبة الكولسترول الشحمي عالي الكثافة High-density Lipoprotein (HDL) إلى أقل من 40 ملغم/ديسيلتر لدى الرجال أو أقل من 50 ملغم/ديسيلتر لدى النساء.
- ارتفاع نسبة الغلوكوز في الدم أثناء الصيام بمقدار 100 ملجم/ديسيلتر أو أكثر.
إنّ الأسباب الكامنة وراءَ متلازمة التمثيل الغذائي هي الوزن الزائد والسمنة وقلة النشاط البدني والاستعداد الوراثي. ويعدّ أساس هذه المتلازمة هو التراكم التدريجي للأنسجة الدهنية وخلل الأنسجة الذي يؤدي بدوره إلى مقاومة الإنسولين.
يتمّ إطلاق السيتوكينات المسببة للالتهابات مثل عامل نخر الورم، والليبتين، والأديبونيكتين، مثبط منشط البلاسمينوجين، والريسستين من الأنسجة الدهنية المتضخمة، مما يغيّر ويؤثر على نقل الإنسولين بشكل سلبي. ويمكن أن يساهم ضعف مسار الإشارة وعيوب مستقبلات الأنسولين وخلل إفراز الإنسولين في مقاومة الإنسولين. ومع مرور الوقت، يؤدي ذلك إلى ظهور متلازمة التمثيل الغذائي التي تظهر على شكل تلف الأوعية الدموية والجهاز اللاإرادي.
إنّ توزيع الدهون في الجسم عاملٌ مهم أيضاً، ومن المعروف أن الدهون في الجزء العلوي من الجسم تلعب دوراً قوياً في تطوير مقاومة الإنسولين. ويمكن أن يكون تراكم الدهون داخل الصفاق أو تحت الجلد. وقد تساهم الدهون الحشوية في مقاومة الإنسولين بشكل أكبر من الدهون تحت الجلد. ومع ذلك، من المعروف أن كلاهما يلعب دوراً في تطور متلازمة التمثيل الغذائي، وفي حالة السمنة في الجزء العلوي من الجسم، يتم إطلاق مستويات عالية من الأحماض الدهنية غير المؤسترة من الأنسجة الدهنية مما يؤدي إلى تراكم الدهون في أجزاء أخرى من الجسم مثل الكبد والعضلات، مما يزيد من مقاومة الإنسولين [13] [14] [15].
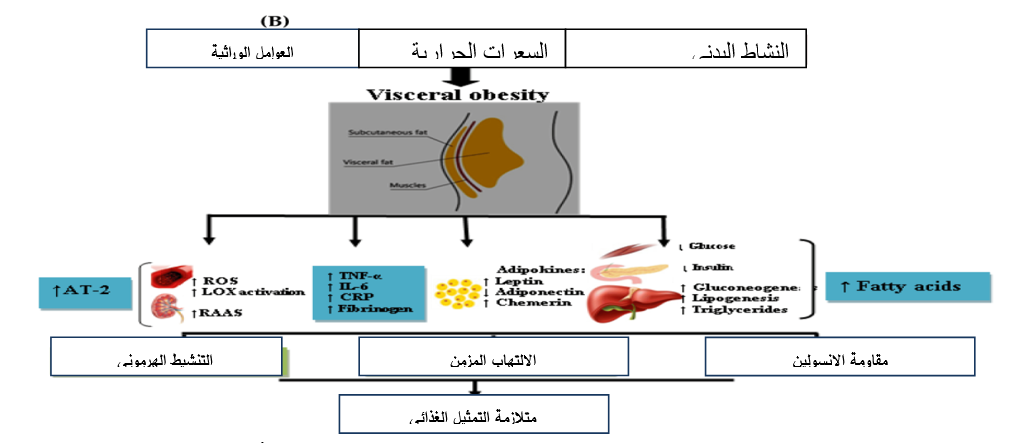
الشكل رقم (2) : رسم تخطيطي للفيزيولوجيا المرضية لمتلازمة التمثيل الغذائي، ROS: أنواع الأكسجين التفاعلية؛ LOX: Lipoxygenase؛ RAAS: نظام الرينين-أنجيوتنسين-الألدوستيرون؛ TNF-α: عامل نخر الورم-α؛ IL-6: إنترلوكين-6؛ CRP: بروتين C التفاعلي؛ AT-2: أنجيوتنسين-2.
الرياضة والحساسية الإنسولين Exercise and Insulin Sensitivity:
ترتبط التمارين الحادة بتحسّن كبير في حساسية الإنسولين. ويمكن لدورة واحدة من التمارين المعتدلة الشدة أن تزيد من امتصاص الغلوكوز بنسبة 40% على الأقل [16]. إضافةً إلى تحسن كبير في تحمّل الغلوكوز وحساسية الإنسولين استجابةً للتدريبات التي يتم الحصول عليها [17].
تعزز التمارين الرياضية أيضاً فقدان الوزن، مما يعكس مقاومة الإنسولين والتي تعتبر سمةً من سمات السمنة، وتقلل التمارين الرياضية الخفيفة من معدلات الإصابة بالمرض والوفيات المرتبطة بأمراض القلب والأوعية الدموية والسكري، فهي تشكل استراتيجية علاجية فعالة للحد من مقاومة الأنسولين. ويمكن عكس داء السكري الذي يحدث نتيجة مقاومة الإنسولين عن طريق ممارسة الرياضة البدنية المعتادة. وبما أنّ السمنة الزائدة في محيط الخصر تساهم في مقاومة الإنسولين، فإن ممارسة التمارين الرياضية بانتظام تساعد في تقليل الدهون في الجسم، وبالتالي زيادة حساسية الإنسولين الخلوي.
يبقى امتصاص الجلوكوز مرتفعاً لمدة تصل إلى 120 دقيقة بعد النشاط البدني، بسبب زيادة وجود GLUT4 في أغشية البلازما والنبيبات T. وتزداد حساسية الإنسولين لمدة 16 ساعة على الأقل بعد التمرين. ويلاحظ ذلك عند الأفراد الأصحاء وكذلك الأشخاص المصابين بداء السكري من النمط 2. [18].
الخاتمة والتوصيات Conclusion :
ارتفعت معدلات الإصابة بمقاومة الإنسولين بشكل كبير بسبب أسلوب الحياة الخاطئ وارتفاع معدلات الإصابة بالسمنة. وترتبط هذه الحالة بالعديد من المضاعفات -في حال عدم علاجها- بما في ذلك أحداث القلب المميتة.
ويوفر النشاط البدني فائدةً مهمة لمرضى السكري وهو جزء لا غنى عنه من الاستراتيجية الشاملة ضد مرض السكري، بسبب التأثير الإيجابي على صحة المصابين بالسكري ومقاومة الإنسولين التي تلعب دوراً رئيسياً في تطور مرض السكري من النمط الثاني والعديد من الأمراض الأخرى، مثل السمنة وارتفاع ضغط الدم وأمراض القلب والأوعية الدموية ومتلازمة التمثيل الغذائي.
المراجع :
1.Seong J, Kang JY, Sun JS, Kim KW. Hypothalamic inflammation and obesity: a mechanistic review. Arch Pharm Res. 2019 May;42(5):383-392.
2.Brown JC, Harhay MO, Harhay MN. The Value of Anthropometric Measures in Nutrition and Metabolism: Comment on Anthropometrically Predicted Visceral Adipose Tissue and Blood-Based Biomarkers: A Cross-Sectional Analysis. Nutr Metab Insights. 2019;12:1178638819831712.
3.Nolan CJ, Prentki M. Insulin resistance and insulin hypersecretion in the metabolic syndrome and type 2 diabetes: Time for a conceptual framework shift. Diab Vasc Dis Res. 2019 Mar;16(2):118-127.
4.Deacon CF. Physiology and Pharmacology of DPP-4 in Glucose Homeostasis and the Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2019;10:80.
5.Thomas DD, Corkey BE, Istfan NW, Apovian CM. Hyperinsulinemia: An Early Indicator of Metabolic Dysfunction. J Endocr Soc. 2019 Sep 01;3(9):1727-1747.
- Hossan T, Kundu S, Alam SS, Nagarajan S. Epigenetic Modifications Associated with the Pathogenesis of Type 2 Diabetes Mellitus. Endocr Metab Immune Disord Drug Targets. 2019;19(6):775-786.
- Kenneth S. Polonsky, Charles F. Burant,Chapter 31 – Type 2 Diabetes Mellitus, Editor(s): Shlomo Melmed, Kenneth S. Polonsky, P. Reed Larsen, Henry M. Kronenberg, Williams Textbook of Endocrinology (Thirteenth Edition),Elsevier,2016, Pages 1385-1450, ISBN 9780323297387, https://doi.org/10.1016/B978-0-323-29738-7.00031-9 (https://www.sciencedirect.com/science/article/pii/B9780323297387000319)
- Petersen MC, Shulman GI. Mechanisms of insulin action and insulin resistance. Physiol Rev(2018) 98(4):2133–223. doi: 10.1152/physrev.00063.2017
- Leto D, Saltiel AR. Regulation of glucose transport by insulin: traffic control of GLUT4. Nat Rev Mol Cell Biol(2012) 13(6):383–96. doi: 10.1038/nrm3351
- Roberts CK, Hevener AL, Barnard RJ. Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training. Compr Physiol. 2013 Jan;3(1):1-58. doi: 10.1002/cphy.c110062. PMID: 23720280; PMCID: PMC4129661.
- Samuel VT, Shulman GI. The pathogenesis of insulin resistance: integrating signaling pathways and substrate flux. J Clin Invest. 2016 Jan;126(1):12-22
- Petersen MC, Shulman GI. Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev. 2018 Oct 01;98(4):2133-2223
- van der Pal KC, Koopman ADM, Lakerveld J, van der Heijden AA, Elders PJ, Beulens JW, Rutters F. The association between multiple sleep-related characteristics and the metabolic syndrome in the general population: the New Hoorn study. Sleep Med. 2018 Dec;52:51-57.
- Burrage E, Marshall KL, Santanam N, Chantler PD. Cerebrovascular dysfunction with stress and depression. Brain Circ. 2018 Apr-Jun;4(2):43-53
- Kim JY, Yi ES. Analysis of the relationship between physical activity and metabolic syndrome risk factors in adults with intellectual disabilities. J Exerc Rehabil. 2018 Aug;14(4):592-597
- Kim JY, Yi ES. Analysis of the relationship between physical activity and metabolic syndrome risk factors in adults with intellectual disabilities. J Exerc Rehabil. 2018 Aug;14(4):592-597
- Holloszy JO, Schultz J, Kusnierkiewicz J, Hagberg JM, Ehsani AA. Effects of exercise on glucose tolerance and insulin resistance: brief review and some preliminary results. Acta Med Scand Suppl. 1986;711:55–65.
18. Holloszy JO, Schultz J, Kusnierkiewicz J, Hagberg JM, Ehsani AA. Effects of exercise on glucose tolerance and insulin resistance: brief review and some preliminary results. Acta Med Scand Suppl. 1986;711:55–65.
-
شارك
-
شارك
-
شارك
الجامعة الوطنية الخاصة
مواقع مرتبطة:
للتواصل :
- سوريا - محافظة حماة - الطريق الدولي حمص حماة
- 0096334589094
- 00963335033
- info@wpu.edu.sy